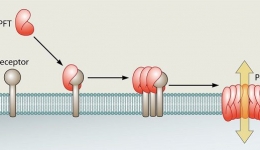
تغییرات و تبدیلات زیست شناختی سموم در بدن (بیوترانسفورماسیون)
/
0 دیدگاه
تغییرات و تبدیلات زیست شناختی سموم در بدن (بیوترانسفورماسیون)
…
جذب٬ توزیع و دفع مواد سمی
جذب٬ توزیع و دفع مواد سمی (Absorption distribution and excretion of to…
 https://acgih.ir/wp-content/uploads/2014/03/تجزیه-و-نمونه-برداری.jpg
183
652
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-10-12 17:36:092018-09-29 13:44:47اصول کلی سم شناسی
https://acgih.ir/wp-content/uploads/2014/03/تجزیه-و-نمونه-برداری.jpg
183
652
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-10-12 17:36:092018-09-29 13:44:47اصول کلی سم شناسی
درسنامه جامع سم شناسی صنعتی
درسنامه جامع سم شناسی صنعتی (Comprehensive Textbook of Industrial…
 https://acgih.ir/wp-content/uploads/2014/08/سموم-صنعتی-گازها.jpg
307
635
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-08-23 19:14:272018-09-29 13:45:23سموم صنعتی گازها
https://acgih.ir/wp-content/uploads/2014/08/سموم-صنعتی-گازها.jpg
307
635
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-08-23 19:14:272018-09-29 13:45:23سموم صنعتی گازها https://acgih.ir/wp-content/uploads/2018/08/الزامات-ایمنی-و-بهداشت-در-واحدهای-صنعتی.jpg
427
700
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-08-20 15:53:502018-09-29 13:45:24سم شناسی ترکیبات کربن دار
https://acgih.ir/wp-content/uploads/2018/08/الزامات-ایمنی-و-بهداشت-در-واحدهای-صنعتی.jpg
427
700
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-08-20 15:53:502018-09-29 13:45:24سم شناسی ترکیبات کربن دار
پاورپوینت کلیات عوامل شیمیایی محیط کار و سم شناسی
توضیحات کلی به شرح زیر است. برای مشاهده کامل توضیحات در ق…
 https://acgih.ir/wp-content/uploads/2014/04/ZN.jpg
205
246
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-04-11 09:58:512020-04-27 17:49:20سم شناسی روی Zn
https://acgih.ir/wp-content/uploads/2014/04/ZN.jpg
205
246
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-04-11 09:58:512020-04-27 17:49:20سم شناسی روی Zn https://acgih.ir/wp-content/uploads/2014/04/Ni.jpg
512
600
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-04-11 00:42:182020-04-27 17:44:15سم شناسی صنعتی نیکل Ni
https://acgih.ir/wp-content/uploads/2014/04/Ni.jpg
512
600
Sirvan Sheikhi
https://acgih.ir/wp-content/uploads/2019/12/lego.png
Sirvan Sheikhi2014-04-11 00:42:182020-04-27 17:44:15سم شناسی صنعتی نیکل Ni

