قوانین فیزیکو شیمیایی گازها
قوانین فیزیکو شیمیایی گازها
حالات فیزیکی مواد:
برای ماده سه حالت فیزیکی یعنی گاز، مایع و جامد شناخته شده است که ماده در شرایط نرمال و طبیعی یکی از این سه حالات را اختیار می کند ولی اکثر مواد در شرایط مناسب محیطی می توانند از یک حالت به حالتی دیگر دگرگونی حاصل نموده و در واقع به هر سه حالت ماده تبدیل بشوند.
برای مثال آب را می توانیم نام ببریم که در فشار و درجه حرارتهای مناسب بصورت آب مایع ، بخار آب و یخ دیده می شود. مایعات و گازها را از آنجایی که قابلیت روان شدن داشته و شکل ظرف خود را اختیار می کنند سیالات می نامند . چگالی و دانسیته این حالات ماده به فضایی که ماده اشغال می کند بستگی دارد. از آنجایی که حجم گازها نامحدود بوده و فاصله بین مولکول ها در گازها زیاد می باشد در نتیجه چگالی یک گاز در درجه حرارت معمولی 25C در حدود تا چگالی حالت مایع و یا جامد آن ماده می باشد. در این بحث ، حالت گاز را بررسی می کنیم.
در گازها فاصله مولکول ها از یکدیگر نسبت به حالت جامد یا مایع خیلی زیاد و نیروهای پیوستگی بین مولکول ها ناچیز است. بنابراین هر مولکول آزادانه به خط راست حرکت می کند تا اینکه به مولکول های دیگر یا به جداره مخزن خود برخورد کند و در اثر این برخورد تغییر مسیر دهد.
سرعت حرکت مولکول ها در گازها زیاد است مثلا سرعت متوسط حرکت انتقالی مولکول های گاز نیتروژن موجود در دمای معمولی به حدود 005 متر بر ثانیه می رسد. به علت همین سرعت زیاد مولکول ها و همچنین به علت ناچیز بودن نیروهای پیوستگی بین آنها که گازها شکل و حجم معینی ندارند. وقتی که گازی درون ظرفی محبوس می شود بر جداره ظرف فشار وارد می اورد. مثلا وقتی که یک بادکنک یا یک توپ بازی را باد می کنید هوای درون آن در تمام جهت تقریبا بطور یکسان بر جدار فشار وارد می سازد.
در این نوع فشار, وزن گاز که خیلی کم است موثر نیست، ولی می توان فشار را براساس ازاد بودن حرکت مولکول هاى گاز چنین توضیح داد: هر مولکول که به جداره ظرف برخورد می کند بر آن ضربه وارد می سازد مانند ضربه ای که یک توپ بازی هنگام برخورد به دیوار بر آن وارد می آورد چون تعداد مولکول هاى موجود در یک گاز حتی در یک حجم خیلی کوچک بسیار زیاد است در هر لحظه میلیارد میلیارد مولکول جدار ظرف را بمباران می کنند. مجموع این ضربه های متوالی بر جدار ظرف به صورت فشار ثابتی ظاهر می شود که بطور یکنواخت بر سطح جدار وارد می گردد. وقتی که گاز درون یک ظرف حجمش ثابت است گرم می شود و فشار آن افزایش می یابد .
این پدیده را می توان چنین توجیه کرد که انرژی گرمائی سرعت حرکت مولکول های گاز را بیشتر می کند. بنابراین مولکولها با ضربه شدیدتری به جدار ظرف برخورد می کنند و در نتیجه فشار بیشتری بر جدار ظرف وارد می شود . بنابراین وضعیت یک گاز در صورتی مشخص می شود که فشار و حجم و دمای آن معین باشد.
پس در کار کردن با حالت گازی یک ماده باید سه کمیت حجم ، درجه حرارت و فشار را در نظر داشت که این کمیت ها را در زیر تعریف می کنیم .
حجم: حجم برابر با فضایی است که ماده اشغال می کند و در واقع حجم یک ماده در اثر فواصل بین اتم و مولکول های آن بوجود آمده است . حجم را برحسب ليتر, میلی لیتر و یا سانتی متر مکعب اندازه می گیرند . برای جامدات ولی برای گازها
و مایعات حجم در اثر تغییر فشار و درجه حرارت تغییری قابل توجه نمی یابد ولی برای گازها حجم تابعی از فشار و درجه حرارت است.
درجه حرارت : عبارتست از اختلاف سطح گرمائی بین دو نقطه است و برای اندازه گیری حرارت دستگاهی بنام میزان الحراره استفاده می شود. سیستم های اندازه گیری درجه حرارت عبارتند از سیستم سانتی گراد یا سلسیوس, سیستم فارنهایت و سیستم
درجه حرارت مطلق یا کلوین . در سروکار داشتن با گازها از سیستم درجه حرارات کلوین استفاده می شود. که آنرا K نمایش می دهند (حرف k به افتخار لرد کلوین دانشمند بزرگ انگلیسی برگزیده شده است).
حد پایین این سیستم صفر مطلق می باشد. و بدست آوردن درجه حرارتی پائین تر از صفر مطلق غیرممکن است، آب در K 273.16 ذوب می شود و در K373.16 بجوش می آید.
نقطه ذوب آب یعنی K ۲۷۳ برابر با صفر درجه سانتیگراد و ۳۲ درجه فارنهایت است. نقطه حواشی ۳۷۳ درجه کلوین برابر با به 100 درجه سانتیگراد و ۲۱۲ درجه فارنهایت است و صفر مطلق ابر ۲۷۳- درجه سانتیگراد و 459.7-درجه فارنهایت قرار دارد.
برای تبدیل سیستم های حرارتی به یکدیگر از فرمول های زیر استفاده می شود:
C0 + 273.16 = K0
(F0 – 32) ×5/9 +273.16= K0
فشار: منظور از فشار، نیرو بر واحد سطح است. نیروئی که اتمسفر بر یک سانتیمتر مربع از سطح دریا وارد می کند برابر با ستونی از جیوه بطول ۷۶ سانتیمتر می باشد. برای اندازه گیری فشار از دستگاهی بنام بارومتر که اولین بار توسط توریچلی اختراع شد استفاده می شود. فشار هوا در صفر درجه حرارت در سطح دریا در حدود 760 میلیمتر جیوه می باشد که بنام یک اتمسفر خوانده می شود . ولی کلا در شرایط عادی فشار در سطح دریا بین به 740 تا به 780 میلیمتر جیوه متغیر است.
قانون بویل – ماريوت (Boyle-Mariotte ) (رابطه بین حجم و فشار گازها در دمای ثابت ) :
استوانه ی مسدودی را در نظر بگیرید که دهانه ی بالائی آن بوسیله ی پیستون بدون منفذی بسته شده است و پیستون می تواند به آسانی در استوانه حرکت کند و درون استوانه گازی مانند هوا وجود دارد . چنانچه دما ثابت باشد حجم گاز درون استوانه بستگی به فشاری دارد که توسط پیستون بر آن وارد می شود . اگر پیستون به طرف پایین رانده شود ، فشار بیشتری بر گاز وارد می سازد و حجم گاز کم می شود. ولی گاز هم به نوبه ی خود در مقابل فشار پیستون ایستادگی می کند و عمل تراکم وقتی متوقف می شود که فشار گاز برابر فشار پیستون باشد. قانونی که رابطه بین حجم و فشار مقدار معینی گاز را در دمای ثابت نشان می دهد. نخستین بار توسط بویل (1627-1691 م) در انگستان و ماریوت (1620-1684 م) در فرانسه جداگانه بدست آمده است. طبق این قانون که آن را بویل-ماریوت می نامیم حجم یک گاز که دمای آن همواره ثابت باشد به نسبت عکس فشاری که بر آن وارد می شود تغییر می کند. یعنی اگر فشاروارده بر سطح پیستون دو یا سه یا چهار برابر شود حجم گاز درون استوانه نصف یا ثلث یا ربع می شود. از طریف دیگر اگر فشار کم شود و مثلا به نصف یا ثلث مقدار اولیه خود برسد. گاز پیستون راه طرف بالا می راند بطوری که حجمش به دو برابر یا سه برابر اولیه می رسد.
شکل1: نمایش تغییرات فشار و حجم در پیستون
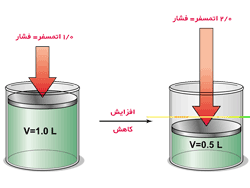
تغییرات فشار و حجم در پیستون
بنابراین:
حجم یک گاز در دمای ثابت با عکس فشار آن است.
از نظر ریاضی قانون بویل ماریوت را می توان به صورت زیر نمایش داد:
فرمول ها در فایل پیوستی می باشند
V نمایش حجم گاز و P نمایش فشار آن و ∼ علامت تناسب است. نتیجه آنکه:
V = مقدار ثابت
P.V =مقدار ثابت
مثلا اگر در فشار P1 حجم گاز V1 باشد و در فشار P2 حجم آن V2 شود, داریم:
P1V1 = P2V2 = مقدار ثابت
این قانون در همه موارد صادق نیست. در گرمای کم و زیاد شدن فشار, انجراف شدیدی از این قانون مشاهده می شود (مایع شدن گاز در بعضی موارد)
قانون شارل-گیلوساک ( Charles-Gay-Lussac)
گازها وقتی فشارشان ثابت بماند در اثر گرما حجمشان افزایش می یابد. قانون تغییرات حجم گازها با دما در فشار ثابت توسط شارل (1823-1746 م) و گیلوساک (1850-1778 م) فیزیکدانان فرانسوی جداگانه کشف شده است. این قانون به نام قانون شارل-گیلوساک به صورت زیر بیان می شود:
هر گاه فشار گازی ثابت بماند در صورتی که دمای آن به اندازه یک درجه سانتی گراد افزایش یابد تقریبا به اندازه حجمی که گاز در دمای صفر درجه سانتیگراد دارد افزایش حجم می یابد.
به عبارت دیگر ضریب انبساط حجمی گازها در فشار ثابت تقریبا برابر بر درجه سانتیگراد است .
جدول و نمودار زیر اندازه های تقریبی یک گاز را در فشار ثابت برای دماهاى مختلفی که برحسب درجه سلسیوس و درجه کلوین انتخاب شده اند نشان می دهند و برای آسانی مقایسه حجم نمونه در صفر درجه سانتیگراد برابر ۲۷۳ سانتیمتر مکعب انتخاب شده است.
ادامه قوانین فیزیکو شیمیایی گازها را که شامل موضوعات زیر است را با دانلود فایل پیوستی مشاهده کنید.
- قانون دالتون (Dalton) (فشار مخلوط چند گاز)
- قانون عمومی گازها
- محاسبه فشار بخار آب در هوا
- قانون گراهام (سرعت نفوذ گازها)
- تئوری سینستیک گازها Kinetic Theory
- سرپیچی از قوانین گازهای کامل
- درجه حرارت بحرانی Critieal Temperature
حتما بخوانید:
⇐ گازهای قابل انفجار و اشتعال سریع



دیدگاهتان را بنویسید
می خواهید در گفت و گو شرکت کنید؟خیالتان راحت باشد :)