پاورپوینت قوانین گازها
پاورپوینت قوانین گازها
پاورپوینت قوانین گازها
فرمت: PPT تعداد صفحات: 61
فشار: به عنوان نیروی وارد بر سطح تعریف می شود.
اتمسفر (جو) بر سطح زمین فشار وارد می کند و دستگاهی که برای اندازه گیری فشار جو بکار می رود، هواسنج نام دارد. اگر فشار عادی جو در سطح دریا اندازه گیری شود، ارتفاع ستون جیوه برابر 76cm یا 760mm جیوه یا 760torr خواهد بود.
واحدهای فشار (p):
الف: پاسکال (Pa): یک پاسکال عبارت است از فشار حاصل از نیروی یک نیوتون بر متر مربع.
ب: اتمسفر: واحد فشار در اندازه گیری های عملی که عبارت است از فشار ستونی از جیوه برابر 76 سانتیمتر جیوه.
Pa=N.m-2 = kgm-1S-2
1 اتمسفر= 10.325KPa
پ: تور (torr): واحد فشار در اندازه گیری های عملی و معادل یک میلی متر جیوه.
torr=101325/760 = 133.32KPa
ج: میلی تور (mtorr): واحد فشار در سیستم های خلأ و فشارهای پایین و برابر یک هزارم تور.
نقطه سه گانه آب: یک ثابت ترمودینامیکی و دمایی که در آن سه فاز آب، بخار آب و یخ می توانند با هم در تعادل باشند.
قانون بویل: حجم یک نمونه گاز در دمای ثابت با فشار گاز نسبت عکس دارد. به تعبیر دیگر حاصل ضرب حجم در فشار یک نمونه گاز در دمای ثابت مقداری ثابت است.
حجم ثابت = PV
در حدود سال 1660 رابرت بویل آزمایشهائی را انجام داد که با استفاده از دستگاهی که در شکل نشان داده شده است تأثیر فشار را بر روی حجم مقدار معینی از هوا در دمای ثابت مورد بررسی قرار داد. به طوری که اگر در داخل لوله خمیده مقداری جیوه ریخته و حجم هوای محبوس را یادداشت کنیم سپس با افزایش جیوه وقتی که فشار روی هوا افزایش مییابد بایستی حجم کاهش یابد، هر گاه این آزمایش را چندین بار تکرار کنیم و هر بار مقادیر فشار و حجم را یادداشت نمائیم ملاحظه میکنیم که در دمای ثابت حاصلضرب فشار در حجم مقداری است ثابت که به قانون بویل معروف است.
ارتباط بین حجم و فشار در گازها
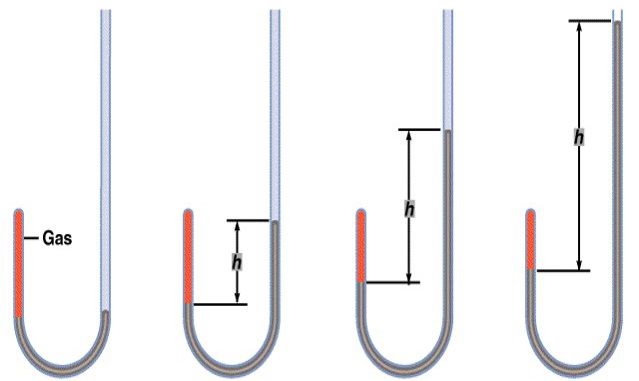
Isotherm تحولاتی را که در دمای ثابت انجام مییابند. ایزوترم یا همدما مینامند. طبق قانون بویل فشار حجم معینی از یک گاز در دمای ثابت طوری تغییر میکند که حاصلضرب PV همواره مقداریست ثابت. گاهی در یک تحول ایزوترم مقادیر اولیه V1 و P1 یک گاز به مقادیر جدید V2 و P2 تغییر مییابد و از آنجائی که حاصل ضرب فشار در حجم مقداریست ثابت قانون بویل را میتوان بصورت زیر نوشت:
P1V1 = P2V2
گازهائی که از قانون بویل تبعیت میکنند به اسم گازهای ایـدهال یـا کـامل (ideal gas) یا (perfect gas) معروف هستند. اندازهگیریهای دقیقتر در خصوص برخی از گازها چنین نشان میدهد که در حقیقت گازها کاملاً بر طبق قانون بویل رفتار نمیکنند که این رفتار را رفتار غیر ایدهال گازها (non-ideal gas)، (imperfect gas) یا (real gas) مینامند. بایستی اضافه کرد که در گازهای کامل حاصلضرب فشار در حجم مستقل از مقدار فشار هست بدین معنی که تغییرات فشار تأثیری بر مقدار حاصل ضرب PV نخواهد داشت.
قانون شارل – گیلوساک:
با تغییر حجم گازی V1 و دمای T1 به حجم گازی V2 و دمای T2 در فشار ثابت، روابط زیر را داریم:
pV1=nRT1
pV2=nRT2
به طور کلی در فشار ثابت:
مقدار ثابت = V1/T1=V2/T2=V/T
گاز ایده آل: گازی که نیروهای بین مولکولی آن صفر، یعنی نبودن هیچ گونه نیروی جاذبه یا دافعه بین مولکول های آن.
گاز حقیقی در صورتی ایده آل است که:
الف: بسیار رقیق
ب: میل کردن فشار آن به سمت صفر
در این صورت به دلیل ناچیز بودن نیروهای بین مولکولی گاز حقیقی خصلت گاز ایده آل را دارد. مقدار R، به مقدار کمیت های P و V و T بستگی دارد.
کالری: افزایش دمای یک گرم آب به اندازه یک درجه در دمای داده شده
1Cal= 4.184 j
حجمهای مساوی از گازها در شرایط یکسان فشار و دما شامل تعداد مولکولهای مساوی هستند. چنین استنباط میشود که یک مول از یک گاز در شرایط معینی از دما و فشار همان حجمی را اشغال میکند که یک مول از هر گاز دیگر. در صورتیکه R را بعنوان ضریب تناسب وارد نمائیم تساوی زیر را خواهیم داشت:
PV = n RT
رابطه بدست آمده را رابطه گاز کامل یا گاز ایدهآل مینامند و در مورد تمام گازهائی که بصورت ایدهال رفتار میکنند به کار برده میشود.
محاسبه مقدار R:
مقدار R را از رابطه گازهای کامل در شرایط متعارفی (STP) Standard Temperature and Pressure میتوان حساب کرد.
t = 0 oC
T = 0 + 273.15 = 273.15 K
P = 1 atm
چون یک مول از گازها در شرایط متعارفی 22.4 لیتر حجم دارد:
n = 1 mol
V = 22.4 lit
خواهیم داشت:
PV = n RT
ثابت گاز یعنی R دارای بعد انرژی است چرا که فشار را برابر نیرو بر واحد سطح و حجم را به شکل سطح ضربدر طول مینویسیم و بعد R (دیمانسیون) مشخص میگردد.
فشار × حجم = سطح × طول = نیرو × طول
ابعاد نیرو ضربدر طول همان ابعاد انرژی است که بر مبنای نیرو ضربدر تغییر مکان متکی میباشد. لذا R دارای بعد انرژی بر درجه کلوین بر مول میباشد.
ادامه مطلب را با دانلود فایل پیوستی مشاهده کنید.
ورود یا ثبـــت نــــام + فعال کردن اکانت VIP
مزایای اشتراک ویژه : دسترسی به آرشیو هزاران مقالات تخصصی، درخواست مقالات فارسی و انگلیسی، مشاوره رایگان، تخفیف ویژه محصولات سایت و ...
حتما بخوانید:




دیدگاهتان را بنویسید
می خواهید در گفت و گو شرکت کنید؟خیالتان راحت باشد :)