مدیریت ریسک و مخاطرات در صنایع دارویی
مدیریت ریسک و مخاطرات در صنایع دارویی
مدیریت ریسک و مخاطرات در صنایع دارویی
فرمت: pdf تعداد صفحات: 16
فهرست:
- چکیده
- تعریف و تبیین ریسک در صنایع داروئی
- مدل جامع سیستم کیفیت دارویی موثر و ارزیابی ریسک در آن
- اهداف سیستم ICH Q10
- جایگاه ریسک در سیستم ICH Q10
- اصول کلیدی مدیریت ایمنی در صنایع دارویی
- سه قدم عمده برای ایجاد فرهنگ
- ارزیابی ریسک در صنایع دارویی
- ابزار ارزیابی ریسک عملکردی
- مدیریت ریسک کیفیت برای صنایع دارویی
- ایمنی عملکردی در صنایع دارویی
چکیده:
امروزه با توجه به حساسیت ویژه صنایع دارویی از لحاظ کیفیت محصولات از یک طرف و الزام مقابله با ریسک ها و مخاطرات شغلی و سیستماتیک از طرف دیگر، ضمن احساس لزوم همپوشانی و هم افزایی سیستم های مدیریت ایمنی، کیفیت، زیست محیطی و بهداشت شغلی لزوم توجه به مقوله مدیریت ریسک و مخاطرات در این صنایع بیش از پیش حیاتی تر می گردد. مقوله مدیریت ریسک در صنایع داروئی همواره از دو دیدگاه مورد بررسی قرار گرفته است، دیدگاه اول ایمنی شغلی بوده و دیدگاه دوم مدیریت ریسک کیفیتی می باشد. در مقاله حاضر سعی بر این است که ضمن تشریح سیستم ارزیابی و مدیریت ریسک در صنایع داروئی، مدل ها و راهکارهای موجود و مدل پیشنهادی به این منظور مورد بحث قرار گیرد.
کلمات کلیدی: مدیریت ریسک، مدیریت ریسک برای صنایع دارویی، فرهنگ وقوع صفر، ایمنی عملکردی
مقدمه) تعریف و تبیین ریسک در صنایع داروئی:
امروزه ایمنی به معنی تلاش برای جلوگیری از آنچه که باعث کاهش میزان محصول یا نتیجه کار و پایین آمدن کیفیت و هدر رفتن نیرو و تلاش های صرف شده در انجام کار می گردد ، تلقی می شود ریسک در صنایع داروئی به عنوان مجاورت با یک مخاطره یا ایجاد ضایعات در محیط (نظیر وقوع بیماری در اثر ریسک عفونت) تعریف می شود. هر محصول و هر فرآیند دارای ریسک توام با آن می باشد و هر بنگاه یا مرکز تولیدی بایددارای متدولوژی جهت شناسایی و ارزیابی ریسک های موجود در آن بوده و همچنین دارای فرآیندی برای تهیه طرح قاطع جهت کاهش ریسک تا حد قابل قبول باشد. این برنامه ، برنامه مدیریت ریسک نام دارد. از دید کنسول بین المللی انجمن های شیمیایی آسیب و ریسک در صنایع داروئی به صورت زیر تعریف می شود :
آسیب (مخاطره): خاصیت ذاتی یک ماده از لحاظ دارا بودن پتانسیل تاثیرات نامطلوب بر انسان یا محیط.
ریسک: احتمال وقوع تاثیر سوء ناشی شده از وقوع مخاطرات می باشد.
مطابق شکل (۱) مدیریت ایمنی در صنایع دارویی شامل مراحل: ارزیابی ریسک، مدیریت ریسک و اطلاع رسانی ریسک می باشد.
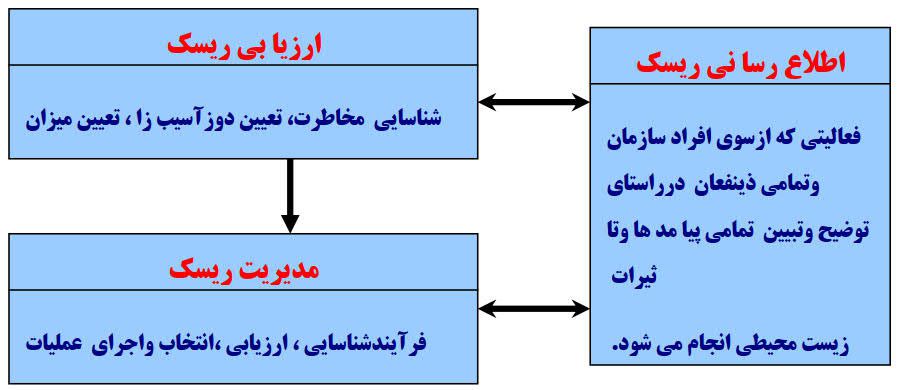
شکل ۱) مراحل مدیریت ایمنی در صنایع دارویی
توجه شود که یکی از وجوه بارز مدیریت ریسک در صنایع دارویی اطلاع رسانی در این مورد (Risk Communication) می باشد
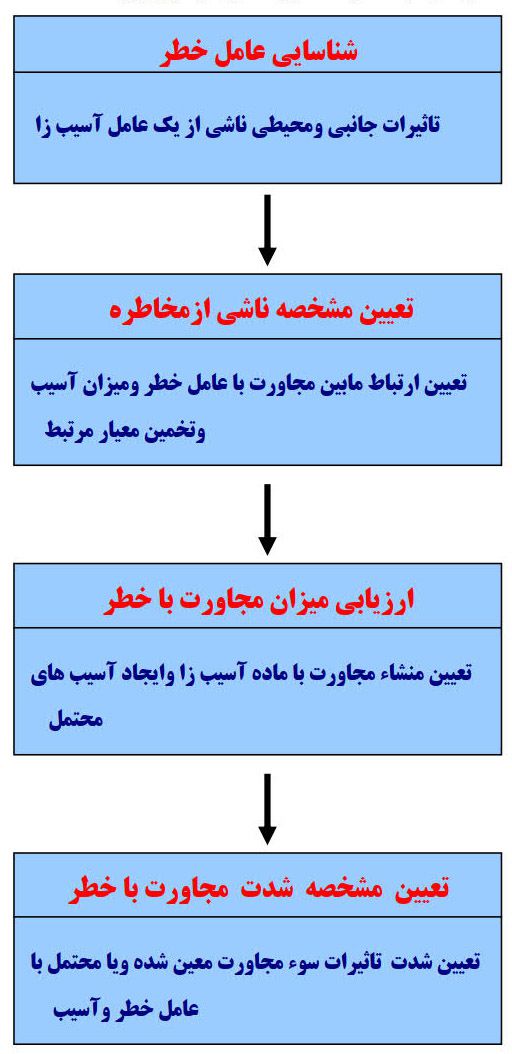
شکل ۲) مراحل ارزیابی ریسک در صنایع دارویی
مدل جامع سیستم کیفیت دارویی موثر و ارزیابی ریسک در آن
ICH Q10 یک راهنمای FDA و یا به عبارت بهتر یک مدل جامع برای سیستم کیفیتی موثر می باشد که براساس موضوعات سیستم مدیریت کیفیت ( ISO) و قواعد GMP بوده و دارای دو راهنمای مکمل (ICH Q8 در مورد توسعه دارویی و ICH 09 در مورد مدیریت ریسک کیفیت) می باشد (شکل 3).
اهداف سیستم ICH Q10
سیستم کیفیت دارویی شامل ICHQ10 جستجو کننده اهداف محکم شامل موارد زیر است:
- تحقق محصول: تولید کنندگان در جستجوی محصولی هستند که بصورت پایدار تامین کننده نیازهای بیماران، مراکز درمانی و مشتریان داخل خود صنایع دارویی باشد.
- ایجاد و تثبیت حالت کنترلی مورد نیاز: این هدف بوسیله سیستم پایش موثر برای فرآیندهای عملکردی و کیفیت محصول به منظور تامین تضمین جهت مناسب بودن و توانمندی فرآیند موردنیاز محقق می شود.
- تسهیل حرکت به سمت بهبود مستمر: شامل شناسایی و اجرای بهبود کیفیت محصول مورد نیاز، بهبود فرآیند، کاهش نوسانات، نوآوری ها و ترقی سیستم کیفیت دارویی که موجب افزایش توانمندی جهت تامین کامل لازمه های کیفیتی می باشد. تکنیک های مدیریت ریسک برای شناسایی نواحی موردنیاز به بهبود نیز در این صنعت کاربرد دارد.
سیستم کیفیت دارویی اشاره شده در ICH Q10 روی چهار عنصر ویژه زیر تاکید دارد:
- سیستم مدیریت تغییر
- سیستم پایش عملکرد در مورد کیفیت محصول و عملکرد فرآیند
- سیستم اقدامات اصلاحی و پیشگیرانه
- بازنگری مدیریت کیفیت فرآیند و محصول
ادامه مطلب را با دانلود فایل پیوستی مشاهده کنید.
ورود یا ثبـــت نــــام + فعال کردن اکانت VIP
مزایای اشتراک ویژه : دسترسی به آرشیو هزاران مقالات تخصصی، درخواست مقالات فارسی و انگلیسی، مشاوره رایگان، تخفیف ویژه محصولات سایت و ...
حتما بخوانید:
⇐ گزارش کارآموزی بهداشت حرفه ای در کارخانه داروپخش و راهکارهای آن




دیدگاهتان را بنویسید
می خواهید در گفت و گو شرکت کنید؟خیالتان راحت باشد :)